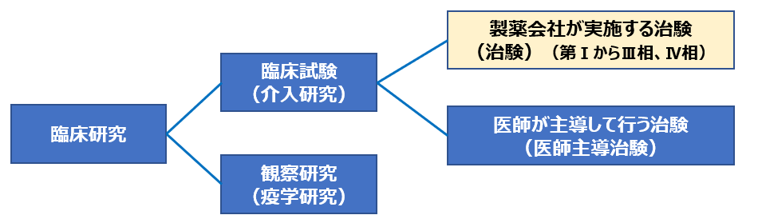
臨床試験とは
患者さんや健康な方(ヒト)を対象として、医薬品や医療機器、外科的手技などの治療(介入といいます)を試験し、有効性や安全性などを検討することを臨床試験といいます。なお、医薬品の場合は、治験(第Ⅰ相、第Ⅱ相、第Ⅲ相)と製造販売後調査(臨床試験として行われることもあります)(第Ⅳ相と呼ばれる)があります。
治験は国(厚生労働省)に認められるまでに行われる臨床試験のことを指し、製造販売後臨床試験は国に承認されてからの試験となります。
臨床研究という言い方もありますが、これは対象範囲が広く、病気の予防、診断や原因究明、治療方法の改善等のために、ヒトを対象として行われるすべての研究のことを指し、観察研究と臨床試験からなります
第1相試験
少数の健康な成人又は患者さんを対象として、少ない用量から投与し、安全性を確認しながら、順に予定する用量まで増量します。併せて、くすりの吸収・代謝・排泄の様子も調べます。
第2相試験
比較的少数の患者さんに対して、第1相試験で安全性が確認された用量の範囲で薬剤が使用され、薬の安全性(副作用はどの程度か、あるいは有害事象の重篤度)、効き目(有効性)、適切な投与量・投与感覚・投与期間)を確認します。確認の方法として、プラセボ(偽薬といい、有効成分を含まず、見かけ上、有効成分を含む製剤と区別がつかないもの)や既に承認されている標準的な薬剤との比較試験を行うことがあります。
第3相試験
多数の患者さんに対して薬剤を使用し、第2相試験よりも詳細な情報を集め、実際の治療に近い形での薬の効き目と安全性を確認します(上記は東大病院臨床研究推進センターより再掲、一部加筆)。
第4相試験(製造販売後調査)
より多くの患者さんに薬物治療した際に発生する副作用、有効性(薬剤の効き目)や使用状態調べます。製造販売後調査は、1)副作用・感染症報告制度、2)再審査制度、3)再評価制度の3つの制度で構成されています。1)の副作用・感染症報告制度は重篤な副作用の拡大を防ぐ制度になります。
臨床試験を実施する際に規則として医薬品の臨床試験の実施の基準に関する省令(GCPと呼ばれています)があり、試験を主導する医薬品メーカーや医療機関は従う必要があります。また、患者さんの人権、安全および福祉の保護、ならびにプライバシーと秘密の保全は確保されます。臨床試験を実施するには、世界医師会で1964年に採択された「ヘルシンキ宣言」の精神のもと(その後何度か改訂されています)、試験の参加者の安全と人権を守ることが最優先されます。
臨床試験の試験という言葉からは、実験とか測定を連想されるかもしれませんが、安全性や有効性を客観的に調べる手法となります。具体的には無作為化比較試験(または、ランダム化比較試験)、二重盲検法などがあります。無作為化二重盲検プラセボ対照試験(Randomized double blind placebo control studies)は介入試験においては“ゴールドスタンダード”と言われ、この試験による結果は信頼性が最も高く、エビデンスとして参照されます。
治験に参加する
メリット
・詳細な診察や検査が行われ、通常の診療より丁寧にみてもらえ、自身の病気の状況を詳しく知ることができます
・同じような病気と闘っている患者さんのためにもなり、医療の進歩に貢献することになります
デメリット
・通常より診療回数が増えたりすることから、患者さんの交通費などの負担を軽減するために、協力費(負担軽減費)がある場合もあります
・医薬品の場合は、予測しない副作用や有害事象がみられたり、対処の仕方が難しい副作用が出たりする可能性もあります
遺伝子治療の治験
遺伝子治療の目的に使用される医薬品(治験薬を含む)については、厚生労働省の通知によると、「新たな治療機会を失うことにより被るかもしれないリスク」と治験薬によりもたらされるリスクの大小を勘案し、かつ、これらすべての情報を開示した上で患者の自己決定権に委ねるという視点をもうことを考慮すべきとしています。
厚生労働省:遺伝子治療用製品等の品質及び安全性の確保について (薬生機審発0709第2号令 和 元 年 7 月 9 日 )によると
・・・・遺伝子治療用製品等の治験を開始するに当たっての基本的留意点は、当該製品のヒトへの適用により支障となる品質及び安全性上の明らかな問題が存在するか否か、臨床で得られた知見との関係性を照合できる程度に品質特性が把握され、その一定範囲の恒常性が確保されているか否かを確認することにある。その際、明らかに想定される製品のリスクを現在の学問・技術を駆使して排除し、その科学的妥当性をまず明らかにすべきである。その上で、なお残る未知のリスクと、重篤で生命を脅かす疾患、身体の機能を著しく損なう疾患、身体の機能や形態を一定程度損なうことによりQOL を著しく損なう疾患等罹患し従来の治療法では限界があり克服できない患者が、「新たな治療機会を失うことにより被るかもしれないリスク」とのリスクの大小を勘案し、かつ、これらすべての情報を開示した上で患者の自己決定権に委ねるという視点を持つことを考慮する必要がある。すなわち、リスク・期待されるベネフィットの情報を開示した上で、治験に入るかどうかの意思決定は患者が行うという視点を入れて評価することも重要である・・・・・
臨床試験の情報があるところ
- 国立保健医療科学院 臨床研究情報ポータルサイト
- 臨床試験情報(Japic Clinical Trials Information)
- U.S. National Library of Medicine – ClinicalTrials.gov
参考情報
- 国立がん研究センター がん情報サービス
- 東大病院臨床研究推進センター
- ヘルシンキ宣言
- 厚生労働省:遺伝子治療用製品等の品質及び安全性の確保について
