ハンチントン病(HD)の新しい治療薬に関する臨床試験(治験を含む)は欧米を中心に進められており、毎年新たな報告が発表されています。ここでは、2025年2月に米国カリフォルニア州で開催された「第20回ハンチントン病治療薬カンファレンス(CHDI主催)」で紹介された内容と、その後の追加情報を簡潔にまとめます。
内容
1.はじめに
2.HD治療薬開発の進捗状況
3.概要説明(臨床試験の結果)
4.補足情報:治療技術(モダリティ)や知見

1.はじめに
臨床試験の状況は日々変化しているため、本稿が常に最新の情報を反映しているとは限りません。信頼性が高いと考えられる資料に基づいて作成していますが、情報の正確性や完全性を保証できるものではありません。また、現時点では日本国内で臨床試験は実施されていません。
これらの薬剤開発は依然として臨床試験の段階にあり、治療法として確立されるには、なお時間が必要です。ただし、複数の製薬企業や研究チームが多様なアプローチで開発を進めており、開発は継続しています。私たち患者会としても今後の動向を注視し、分かりやすい形で情報をお伝えしていきます。(記:JHDNホームページ編集会議メンバー)
<参考にした情報源>
・Huntington’s Disease Therapeutics Conference 2025 – Day 1
・Excitement and Anticipation as PTC’s Huntington’s Disease Drug Clears a Major Hurdle to Sprint Home
・PTC518 PIVOT-HD Study Achieves Primary Endpoint
・uniQure Provides Regulatory Update on AMT-130 for Huntington’s Disease「臨床試験」の内容は、こちらを参照してください
https://www.jhdn.org/latest-study/clinical-trial/
2.HD治療薬開発の進捗状況
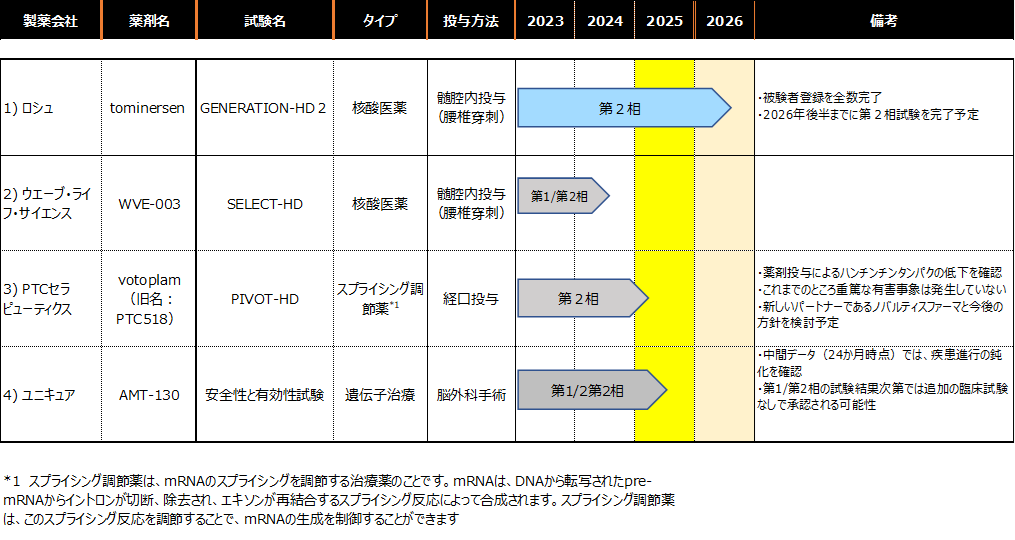
2025年2月時点で臨床試験が行われているHD治療薬の進捗状況は下表の通りです。
3.概要説明(臨床試験の結果)
下記の情報は2025年2月(第20回ハンチントン病治療薬カンファレンス)以降に発表されたプレスリリースなどをもとにまとめています。
1)ロシュ社(薬剤名:トミネルセン(tominersen))
・新しい臨床試験(GENERATION-HD2)で、予定された被験者の登録が完了しました。
臨床試験の状況や結果
・ GENERATION-HD2は15カ国、70施設で2026年後半までに試験完了予定です。
*GENERATION-HD1は2022年に安全性に問題があり中止しました。
・ 今後の臨床試験の設定のため、HDレギュラトリーサイエンス・コンソーシアムと協力し、これまでの研究から得られたデータ、自然史データ(*)、GENERATION-HD1試験から得られた薬剤を投与していない人のデータを共有しています。
(*) 自然史データとは、主に観察研究に基づいており、疾患の発生や進行の過程を追跡するデータのこと)
2)ウェーブ・ライフ・サイエンス社(薬剤名:WVE-003)
・異常なハンチンチンタンパク(HTT)のみを抑えるように設計された薬。
・脳の萎縮の進行を抑える可能性が報告されている。
臨床試験の状況や結果
・薬剤を服用している人の脳の萎縮を遅らせることを示しました(将来の臨床試験において、この指標を採用することを検討)
・ただし、本指標のみでは薬剤の治療効果を判断できないため、他のバイオマーカーも分析した上で慎重に判断する必要があります。
・2025年末までに第2相/第3相試験の申請の予定です。
3)PTCセラピューティックス社(薬剤名:ボトブラム(votoplam))
・飲み薬として開発中。
・12か月間の投与で、病気の進行に関わる血液バイオマーカーである神経フィラメント軽鎖(NfL)の変化が抑えられたと報告されました。
・その後の追加発表では、異常なハンチンチンタンパクの減少と安全性が確認され、重篤な副作用は見られていません。
・一部の参加者では、生活機能や認知機能に関わる検査で改善の傾向が報告されています。
臨床試験の状況や結果
・安全性:これまでのところ、重篤な有害事象(SAE)は発生していません。
12か月経過時点(投薬後)
・病態ステージで群分けして解析すると、ステージ2ではNfL低下傾向があった(用量依存性は確認できず)。
・NfL spike(一過性の急上昇)は発現していません。
(これは先行で臨床試験を実施し中止となったtominersen(GENERATION1)やbranaplamで見られた現象です)
24か月経過時点
・用量依存的にNfLが低下(ベースラインは自然歴)
・ハンチンチンタンパク(HTT)の低下:ステージ2およびステージ3のHD患者において、12週時点では薬剤の用量依存的に血中のHTT濃度が低下することを確認しました。
・臨床スコア:ステージ2のHD患者群では、12ヶ月時点で複合統一ハンチントン病評価尺度(cUHDRS)が薬剤の用量依存的に改善しています。一方、ステージ3のHD患者群では用量依存的な改善効果は確認されませんでした。病期によって薬剤の臨床効果が異なる可能性を示唆しています。
・昨年データが共有された患者の24ヵ月間の治療データとENROLL-HDレジストリの自然歴コホートの比較:cUHDRSなどの臨床スコアの(薬剤用量依存的な)改善が確認されました。
ステージとは
・ステージについて、ハンチントン病統合ステージ分類(HD-ISS)は4段階で進行を評価していますが、観察研究では必要なデータが欠如して分類が困難な場合があります。本研究では、機械学習を用いてステージを補完し、各ステージ内での進行度のサブグループを定義しています。
・HD-ISS(ハンチントン病統合ステージ分類)の各ステージは、以下のように定義されています。
ステージ0:CAGリピート数が異常(通常は36回以上)で、症状や脳の変化はまだ現れていなく、遺伝的に発症リスクがある段階です。
ステージ1:脳内の線条体(striatum)に萎縮などの構造的変化が見られますが、運動や認知機能に明確な症状はありません。
ステージ2:運動障害(不随意運動など)や認知機能の低下が現れ、ハンチントン病の明確な症状が認められます。
ステージ3:日常生活に支障をきたすほどの機能低下が進行し、自立した生活が難しくなる段階です。
4)ユニキュア社(薬剤名:AMT-130)
・脳外科手術で薬を投与する遺伝子治療。
・米国食品医薬品局(FDA)から先進的な再生医療治療法(RMAT)の指定を取得。
・現在は、血液や機能検査の結果を用いて効果と安全性を慎重に確認している段階。
臨床試験の状況や結果
・中間データ(24か月時点)では、対照群と比較してcUHDRスコアの低下が抑制されていることから疾患進行の鈍化を確認、また、バイオマーカーである脳脊髄液中のNfL低下も確認しました。
・自然史データを使って、薬がどの程度効いているのかを調べようと計画しています。つまり、同じ年齢などで薬を投与されなかったHD患者の平均値と比較します。これは、製薬企業が通常用いるプラセボ対照とは少し異なります。
・薬がどの程度効いているかの指標としてcUHDRSを使用すること、またNfLレベルをAMT-130が作用していることの支持的証拠とみなすことにFDAと合意しました。
・BLAの提出準備(26年第1四半期に提出予定)
受理されれば、追加の臨床試験なしで上市が承認される(販売許可が得られる)と思われます。
(*BLA:Biologics License Application 米国食品医薬品局(FDA)に提出する正式な申請書で、生物学的製剤の米国での販売許可を求めるものです。)
4.補足情報
4.1 治療技術(モダリティ)
・ボトプラム(votoplam)、トミネルセン(tominersen)、WVE-003及びAMT130はいずれともHTT(ハンチンチン)遺伝子の発現抑制薬(HTT-lowering therapies)ですが、同じ治療技術(モダリティ)ではありません。詳細は下表を参考にしてください。
・AMT-130は「単回投与」の遺伝子治療です。他の薬剤は、経口薬として毎日服用、あるいは定期的な髄腔内投与が必要です。

4.2 重要な知見
PTCの試験結果から以下のように重要な知見が示唆されています。
『正常ハンチンチンタンパクと変異ハンチンチンタンパクの両方を抑制しても安全である可能性が示されました。これはtominersen(トミネルセン)やAMT-130のようなに「総ハンチンチンタンパク 」を低下させるアプローチにとって有望な結果と言えます。』
注:SNPはSingle Nucleotide Polymorphism(1塩基多型)を意味する。
